[글로벌 약물시장 분석] 헬스코리아뉴스는 코로나 등 감염병 확산을 계기로 제약·바이오산업에 대한 국민적 관심이 크게 높아짐에 따라 글로벌 시장의 약물개발 현황 및 관련 기업들의 동향을 비중 있게 취재하고 있습니다. 본 뉴스가 독자 여러분의 건강관리와 투자 판단 등에 좋은 정보가 되기를 바랍니다. <편집자 주>
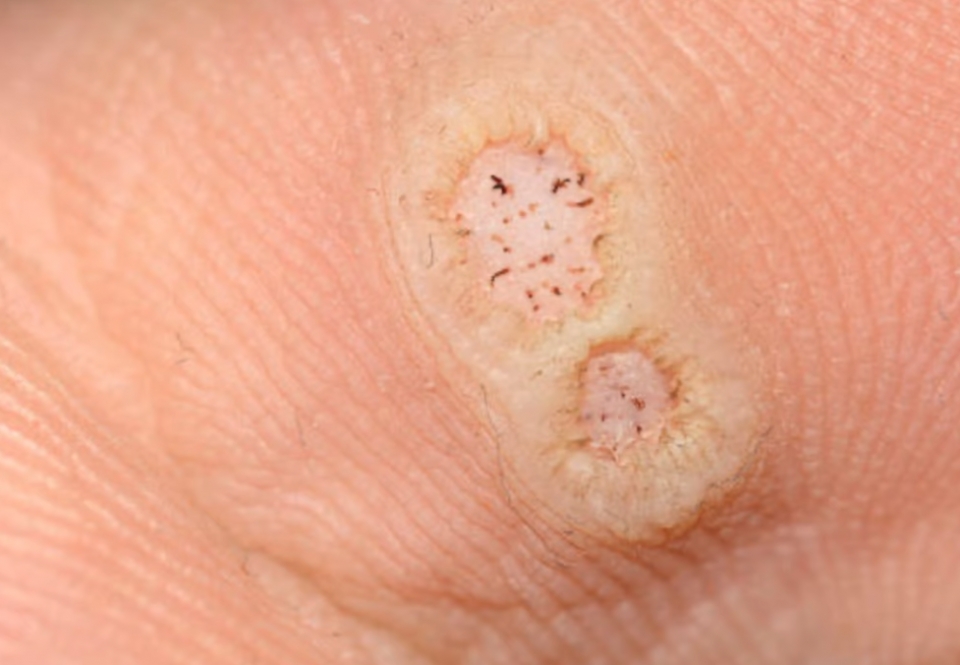
[헬스코리아뉴스 / 이충만] 물사마귀라고도 불리는 전염성 연속종(Molluscum contagiosum, MC)에 대한 사상 첫 번째 도포 치료제가 탄생했다. 주인공은 미국 베리카 파마슈티컬스(Verrica Pharmaceuticals)의 ‘와이캔스(Ycanth, 성분명: 칸타리딘·cantharidin)’이다.
미국 식품의약국(FDA)은 지난 21일(현지 시간), 베리카의 ‘와이캔스’를 만 2세 이상의 전염성 연속종 환자를 위한 도포 치료제로 허가했다. 전염성 연속종에 대한 치료제가 허가를 받은 사례는 이번이 전 세계 최초이다.
이번 허가는 ‘와이캔스’을 평가한 2건의 임상 3상 시험(시험명: CAMP-1 and CAMP-2)의 결과를 근거로 했다. 해당 임상 시험은 만 2세 이상의 전염성 연속종 환자를 대상으로 ‘와이캔스’와 위약의 유효성 및 안전성을 비교한 것이었다.
‘와이캔스’, 50% 안팎 치료 효과 입증
시험 결과, ‘와이캔스’는 두 시험 모두에서 50% 안팎의 치료 효과를 입증하면서 시험의 목표를 달성했다. CAMP-1에서 ‘와이캔스’ 투여군 중 병변이 완전히 제거된 비율은 46%인 반면, 위약군은 18%에 불과했다. CAMP-2에서도 ‘와이캔스’군의 54%가 병변이 말끔히 사라졌지만, 대조군은 13%에 그쳤다.
‘와이캔스’의 안전성 프로파일은 우수했다. 시험에서 관찰된 이상반응은 대부분 경증에서 중등도였다. 이상반응으로 인한 치료 중단율은 ‘와이캔스’군에서 2.3%, 위약군에서 0.5%였다.
전염성 연속종은 폭스 바이러스(Poxvirus)의 일종인 물사마귀 바이러스(Molluscum contagiosum virus) 감염에 의해 피부에 생기는 전염성 피부 병변이다. 단순 접촉으로도 감염될 수 있으며 쉽게 퍼지는 특성이 있다. 감염 시 피부에 작은 융기가 생겨 병변이 나타난다. 대개 별다른 흉터를 남기지 않으나 일부 병변은 작은 흉터나 색소 침착이 생길 수 있다.
전염성 연속종이 발생하여도 대개 자연 치유되기 때문에 그간 허가된 치료제는 없었다. 다만, 급격한 도시화로 인해 알레르기 항원 및 미세 먼지 등의 대기오염으로 인한 피부 자극원이 증가하고, 이에 따라 전염성 연속종 발병 사례가 늘어나면서 새롭게 등장한 미충족 의료 수요로 꼽히곤 했다.
‘와이캔스’는 전염성 연속종을 치료하기 위해 개발된 도포형 치료제이다. 이 약물은 딱정벌레 계통 곤충이 생성하는 터페노이드(terpenoid) 계열의 피부자극제 칸타라딘(cantharidin)의 천연물이다. 터페노이드는 수포형 염증 반응을 유발하는데, ‘와이캔스’는 이점에 착안해 터페노이드의 농도를 희석해서 물사마귀를 진정시키도록 설계됐다.
업계는 ‘와이캔스’의 약가를 약 500 달러로 추정했으며, 최대 3억 달러의 매출을 거둘 것으로 전망한 바 있다.
베리카, 한국 시장 진출도 준비 중
한편, 베리카 파마슈티컬스는 국내 시장에도 진출하기 위해 ‘와이캔스’의 성분인 칸타리딘의 조성물 및 특정 사용 방법을 다룬 2건의 특허를 출원했다.
이중 ‘칸타리딘 및 생활성 칸타리딘 유도체의 상업적으로 실행 가능한 합성’의 건은 지난 2015년 출원됐으며, 올해 4월에 등록이 완료됐다.
특허 등록은 향후 신약 파이프라인의 임상 및 상용화 전략 수립에 있어서도 더 많은 기회와 유연함을 만들어 준다는 점을 고려할 때, 베리카는 국내 시장 상륙을 위한 첫번째 단계를 마쳤다고 볼 수 있다.
또 다른 출원 건인 ‘칸타리딘의 합성’의 경우, 2018년 출원됐고 2020년에 공개됐지만, 아직까지 등록은 완료되지 않은 상황이다.
신약의 국내 도입은 보통 미국 허가 이후 6개월에서 1년 정도 소요된다. 따라서 ‘와이캔스’는 내년 경 국내 시장에 문을 두드릴 것으로 보인다.