글로벌 기업들의 의약품 개발 역사는 질병치료의 트렌드를 반영합니다. 우리 기업들에는 좋은 참고자료가 될 수 있습니다. [편집자 주]
[헬스코리아뉴스 / 이충만] 미국 애브비(Abbvie)의 블록버스터 의약품 ‘휴미라’(Humira, 성분명: 아달리무맙·adalimumab)의 빈자리를 공략하는 제약·바이오 기업들의 열기가 뜨거워지고 있다. ‘휴미라’의 적응증을 경쟁적으로 확보하기 위해 안간힘을 쓰는 가운데, 화농성 한선염 치료 분야가 승패를 가를 핵심 쟁점으로 떠오르고 있는 모양새다.
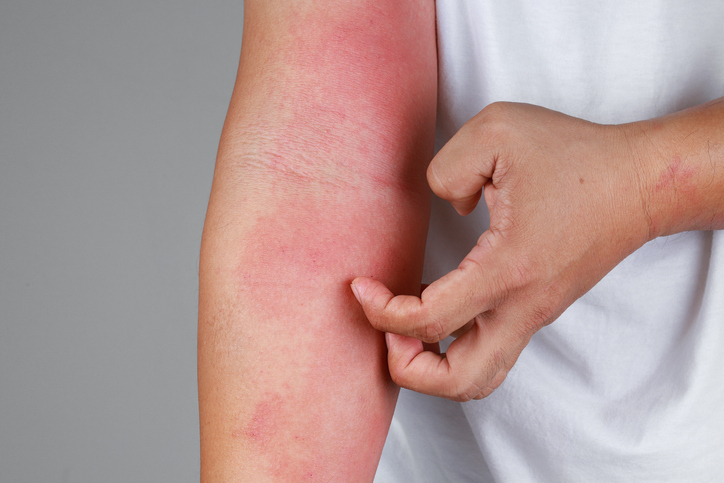
화농성 한선염은 피부 깊이 위치하는 붉은 염증성 결절과 종기로 흉터가 반복적으로 발생하는 만성 염증성 피부 질환이다. 모낭이 막히고 이후 아포크린샘이라고 하는 땀샘에 염증이 생기는 질환이다. 이 땀샘이 있는 곳 중 특히 피부가 접히는 부위에 잘 발생한다. 주된 발생 부위는 겨드랑이, 사타구니, 엉덩이 주변, 항문과 생식기 주변 부위 및 여성의 가슴 아래 부위 등이다.
가장 특징적인 증상은 피부가 접히는 부위에 반복적으로 발생하는 염증이다. 처음에는 붉은 염증성 결절 또는 종기로 나타나며, 염증이 심한 경우 종기가 터지면서 고름이 나오기도 한다. 보통 시간이 경과할수록 더욱 악화되는 경향이 있다. 통증은 점점 심해지고 병변 부위는 넓어지며, 종기가 터지면서 벌어진 피부가 잘 아물지 않아 만성적인 궤양이 생길 수도 있다.
화농성 한선염의 발병 원인은 아직 명확히 밝혀지지 않았다. 하지만, 크론병과 같은 자가염증성 질환과 동반될 수 있다는 점, 26% 정도의 환자가 가족력이 있다는 점에서 호르몬 작용 혹은 면역 체계 이상으로 인해 염증이 생겨나는 것으로 추정된다.
현재 쓰이는 치료법은 주로 항생제와 피지의 분비를 조절하고 피부 각질 및 세균의 과다 증식을 막는 레티노이드를 사용한다. 궤양으로 발전한 경우, 스테로에드 제제를 주사 투약하기도 한다. 하지만, 아직까지 이렇다 할 치료법은 정립되지 않은 상황이다.
이렇듯, 여전히 발병 원인이 불분명함에 따라 화농성 한선염에 대한 미충족 의료 수요는 갈수록 높아져만 가고 있다. 시장 조사 전문업체 퓨쳐 마켓 인사이트(Future Market Insight)는 “문명이 발전하고 생활이 풍요로워지면서 난치성 면역 질환 발병률이 증가하는 추세 속에 화농성 한선염의 발생 건 또한 크게 증가하고 있다”며 “전 세계 주요 7개국 시장(미국, 일본, 영국, 프랑스, 독일, 이탈리아, 스페인)에서 화농성 한선염 치료제 시장은 오는 2033년까지 12억 4090만 달러(한화 약 1조 6268억 2000만 원)에 달할 것”이라고 밝힌 바 있다.
현재 화농성 한선염 치료 전략에서 가장 주목받고 있는 약물 계열은 생물학적 제제이다. 생물학적 제제는 자가면역 질환에 새로운 치료 패러다임을 제시한 것으로 평가되는데, 화농성 한선염이 자가면역 질환으로 추정되는 만큼, 효과적인 치료법으로 자리매김할 수 있다는 것이다.
애브비의 ‘휴미라’는 생물학적 제제 중에서 최초이자 유일하게 화농성 한선염 적응증을 확보한 약물이다. 미국 식품의약국(FDA)은 지난 2015년 9월, 중등도에서 중증의 화농성 한선염 치료제로 ‘휴미라’를 승인했다. 이어 우리나라 식약처는 2016년 1월, 동일한 적응증에 대해 허가를 부여한 바 있다.
하지만, ‘휴미라’는 유럽에서 2018년, 우리나라에서 2022년, 미국에서 올해 1월 30일을 기점으로 특허의 생명력을 잃었다. 바이오시밀러 공습에 직면한터라 ‘휴미라’의 오리지널리티 가치는 점점 떨어지고 있다.
이러한 빈틈을 파고들기 위해 여러 업체들이 화농성 한선염 치료제를 개발 대열에 잇따라 뛰어들었다. 의약품 시장은 여전히 오리지널 선호도가 높은 만큼, 새로운 화농성 한선염 치료제를 선보여 시장을 선점하겠다는 포석인 셈이다.
이중 ▲스위스 노바티스(Novartis)의 인터루킨 억제제 ‘코센틱스’(Cosentyx, 성분명: 세쿠키누맙·secukinumab)과 ▲벨기에 UCB의 인터루킨 억제제 ‘빔젤렉스’(Bimzelx, 성분명: 비메키주맙·bimekizumab)은 허가를 위한 최종 관문만을 남겨두면서 업계의 이목이 집중되고 있다.
‘코센틱스’, 지난해 승인 신청 ... ‘빔젤렉스’, 연내 신청 예정
노바티스는 지난해 9월, 화농성 한선염에 대한 대규모 임상 3상 시험에서 ‘코센틱스’가 긍정적인 결과를 확보했다고 발표한 바 있다.
해당 임상은 1000명 이상의 화농성 한선염 환자를 대상으로 ‘코센틱스’ 2가지 용량의 16주차 및 52주차 치료 유효성 및 안전성을 평가한 것이다. 시험 결과 ‘코센틱스’는 치료 16주차에 약 45%, 52주차에 약 55%의 반응률을 보이며 시험의 목표를 달성했다.
이 회사는 이같은 결과를 바탕으로 지난해 하반기에 유럽 의약품청(EMA)에 판매 허가 신청(MAA)을, 미국 FDA에 신약 허가 신청(NDA)을 동시 제출했다. 노바티스는 승인 여부에 대해 유럽은 올해 1분기, 미국은 올해 2분기에 판가름 날 것으로 보고 있다.
‘코센틱스’는 지난 2015년 1월을 시작으로 자가면역 질환에서 5개의 적응증을 이미 확보한 상태이다. 따라서 화농성 한선염에 대한 적응증을 손에 넣을 경우, 경쟁 약물이자 ‘휴미라’의 후속 약제인 애브비의 ‘스카이리치’(Skyrizi, 성분명: 리산키주맙·risankizumab) 대비 우위를 점할 수 있는 유리한 위치를 차지할 것으로 보인다.
한편, UCB는 현재 화농성 한선염에서 ‘빔젤렉스’를 평가하고 있는 임상 3상 시험의 막바지 단계에 접어들었다. 회사 측은 올해 하반기에 규제 당국에 ‘빔젤렉스’의 승인 신청을 제출한다는 방침이다.
‘빔젤렉스’는 염증과 관련된 사이토킨인 IL-17A와 IL-17F을 억제하는 인터루킨 억제제로, IL-17A와 IL-17F를 이중으로 표적하는 동급 최초 약물이다. 앞서 유럽 집행위원회(EC)은 지난해 8월, 중등도에서 중증의 판상 건선 치료제로 품목 허가했으며, 영국, 일본, 캐나다, 호주, 사우디아라비아, 스위스에서도 순차적으로 허가를 받았다. 하지만 아직까지 FDA의 승인은 획득하지 못했다.






