
[헬스코리아뉴스 / 박원진] 국내 기업이 개발 중인 혈액암 분야 CAR-T 세포( Chimeric Antigen Receptor T cell) 치료제의 완관전해(CR: Complete Response) 비율이 무려 82%에 달했다는 연구결과가 나와 비상한 관심을 끌고 있다. 이는 세계 최초의 CAR-T 세포 치료제로 현재 국내에서도 사용되고 있는 노바티스의 ‘킴리아’보다 훨씬 높은 것이다.
바이오벤처 큐로셀은 이같은 내용을 담은 국내 최초의 CAR-T 치료제 ‘안발셀’(Anbal-cel)에 대한 국내 임상 1상 결과를 11일(현지시간) 열린 유럽혈액학회에서 구두로 발표했다. 발표자로는 임상시험책임자인 삼성서울병원 혈액종양내과 김원석 교수가 나섰다. [아래 관련기사 참조]
이번 발표는 2021년 4월부터 2022년 1월까지 삼성서울병원에서 진행된 국내 최초의 CAR-T 치료제 임상 1상시험의 최종결과이다. 안전성과 유효성 확인을 위한 임상1상 시험 결과, ‘안발셀’(성분명: anbalcabtageneautoleucel, 이하 anbal-cel)을 투약 받은 재발성, 불응성미만성 거대 B 세포 림프종 환자 11명 중 9명의 환자가 완전관해(CR)에 도달했다. 완전관해란 환자의 몸에서 더 이상 암조직을 관찰할 수 없는 상태를 말한다.
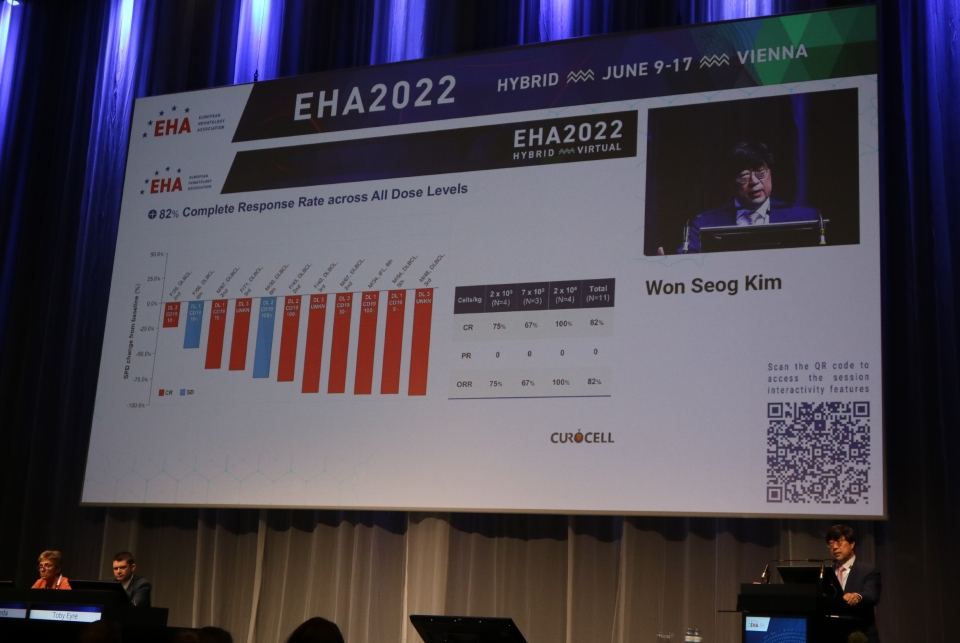
임상 1상에서 확인된 ‘안발셀’의 완전관해율은 82%로 지난달 15일 공개되었던 초록에서의 결과(78%) 보다 개선된 것이다. 초록에서는 9명 환자 중 7명의 완전관해 획득을 공개한 바 있으나 이번 결과는 2명의 환자가 추가됐다.
이번 결과에서 주목할 만한 점은 ‘안발셀’을 투약받은 11명중 9명이 약물에 반응하였고(ORR 82%) 반응을 보인 모든 환자가 완전관해에 도달했다는 점이다(CR 82%). 또한, 가장 적은 용량을 투약 받은 환자 중 2명은 각각 11개월과 13개월 시점에서도 완전관해를 유지하고 있는 것으로 보고됐다. 국내에서 유일하게 시판중인 노바티스 ‘킴리아’의 완전관해율은 40%로 알려져 있다.
이번 발표에서 공개된 ‘안발셀’의 부작용을 살펴보면, CAR-T 치료제의 대표적인 부작용인 3등급 사이토카인방출증후군(CRS)은 2건, 2등급의 신경독성부작용(ICANS)은 1건이 발생하였고 용량제한 독성(DLT)은 관찰되지 않았다.
큐로셀 관계자는 13일 헬스코리아뉴스와의 통화에서 “개발중인 CAR-T 치료제의 우수성을 세계적인 권위를 자랑하는 유럽혈액학회에서 발표하게 되어 매우 자랑스럽다. 이번 1상 임상시험에서는 OVIS™ 기술이 CAR-T 세포의 증식 능력을 향상시킬 수 있음을 확인하였고 이러한 특징이 우수한 임상 결과로 이어졌다고 생각한다”며 “이번 임상을 통해 확인된 OVIS™ 기술의 차별성을 바탕으로 기존 CAR-T 치료제가 갖고 있는 고형암에서의 한계를 극복하는 것을 목표로 삼고 연구개발을 확대하고 있다”고 말했다.
현재 ‘안발셀’의 미만성 거대 B세포 림프종 환자를 대상으로 하는 2상 임상시험은 삼성서울병원, 서울아산병원, 서울대학교병원, 국립암센터, 부산대학교병원등에서 진행하고 있으며 2024년 국내 허가를 목표로 개발하고 있다.
‘안발셀’의 안전성과 유효성을 확인하기 위한 임상시험은 2021년 국가신약개발사업의 신약임상개발 지원과제로 선정되어 진행중이다. 회사측은 이 약물의 다음 과제로 백혈병 치료 부분도 고려중인 것으로 알려졌다.
참고로 현재까지 FDA의 승인을 받은 CAR-T세포 치료제는 미국 BMS의 ▲‘아베크마’(Abecma, 성분명: 이데캅타진 비클류셀·idecabtagene vicleucel) 및 ▲‘브레얀지’(Breyanzi, 성분명: 리소캅타진 마라류셀·lisocabtagene maraleucel), 스위스 노바티스(Novartis)의 ▲‘킴리아’(Kymriah, 티사젠렉류셀·tisagenlecleucel), 미국 길리어드 사이언스(Gilead Sciences)의 ▲‘예스카타’(Yescarta. 성분명: 브렉수캅타진 오토류셀·brexucabtagene autoleucel) 및 ▲‘테카투스’(Tecartus, 성분명: 애시카브타겐실루셀·axicabtagene ciloleucel) 등 6종이 있다.






