[헬스코리아뉴스 / 임도이] 메디포스트가 자사의 골관절염치료제 '카티스템' 등 줄기세포 치료제의 글로벌시장을 확대하기 위한 임상에 박차를 하고 있는 것으로 나타났다.
19일 흥국증권이 내놓은 레포트를 보면, 메디포스트는 현재 줄기세포치료제 개발, 제대혈은행 운영, 건강기능식품 판매까지 3가지 주요 사업을 영위하고 있다. 이 회사의 골관절염 줄기 세포치료제인 카티스템은 이미 국내 시장에 출시돼 있다. K&L grade 2~3 등급의 관절염 중증 진행 환자가 사용 대상이다.
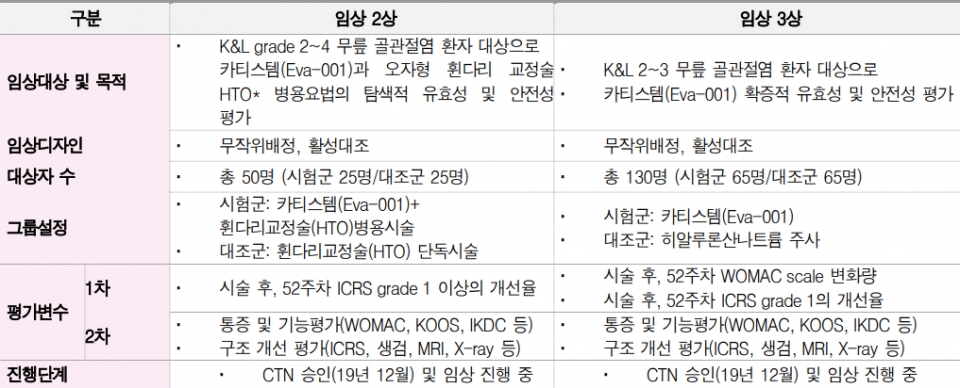
카티스템은 한국에서 5년 이상의 장기추적 데이터가 쌓임에 따라 미국 임상 1,2상을 한국 데이터로 대체하여 바로 임상3상을 진행하고 있다. 일본 역시 초기 임상을 생략하고, 임상 2,3상을 동시에 진행 중이다. 임상2상은 현재 카티스템이 품목허가를 받은 K&L 등급보다 높은 grade 2~4의 중증환자를 대상으로 진행된다.
반면 3상은 K&L grade 2~3로 한국 임상 및 시판데이터를 근거로 1,2상을 생략하고 진행하고 있다. 말레이시아의 경우 현지 임상을 아예 생략하고 정식품목허가(BLA)를 신청한 상황이다. 올해 중에 승인 여부가 결정될 것으로 보인다. 한국 카티스템 적응증 확장 임상은 발목 골관절염을 타깃으로 진행하며 현대바이오랜드에 임상권한을 양도해 진행 중이다. 올해 말 임상3상 종료, 내년에 결과가 공유될 것으로 예상된다.
2세대 줄기세포치료제 SMUP-IA-01 국내 임상 2상
메디포스트는 제조과정에서 제대혈 활용 대량 배양 기술을 활용하여 골관절염 치료제 SMUP-IA-01 파이프라인 국내 임상2상을 진행 중이다. 2021년 10월 임상2상을 승인받아 지난 3월 첫환자 투약에 들어갔다. K&L grade 2~3 환자 90명 대상(저용량 30명, 중용량 30명, 활성대조군 30명 예정)이며, 관절강내 1회 투약 후 1년 관찰 예정 및 장기추적 관찰 예정이다.
SMUP-IA01 파이프라인은 기존의 히알루론산, 스테로이드 주사제로 대체되던 통증을 줄이는 관절강 주사제를 대체하며, 카티스템은 미세천공술, 연골이식술 등 수술요법을 대체해 K&L grade 2~3 환자를 모두 커버하는 전략을 가져갈 예정이다.
줄기세포 파이프라인 크게 4가지
메디포스트의 줄기세포치료제 파이프라인은 크게 4가지로 카티스템 지역 및 적응증 확장 임상, SMUP-IA-01(골관절염), PNEUMOSTEM(기관지폐이형성증), SMUP-IV01(급성호흡증후군) 등이다.
우선 골관절염치료제 카티스템과 SMUP-IA-01의 임상은 K&L grade 2~3 등급의 관절염 중증 환자들을 대상으로 개발되고 있다.
흥국증권 이나경 제약바이오 담당 연구원은 19일 헬스코리아뉴스와의 통화에서 “일본은 줄기세포치료제 급여 품목도 있는만큼 정부에서 시장을 성장시키고 있어 안정적인 임상 진행이 기대된다”며 “말레이시아의 경우 현지 임상을 아예 생략하고 정식품목허가(BLA)를 신청한 상황이어서 올해 중에 승인 여부가 결정될 것으로 보인다”고 말했다.
PNEUMOSTEM은 미숙아 기관지폐이형성증 치료제로 현재 경쟁약물이 존재하지 않아 미국 내 희귀 의약품 및 Fast Track(2019년 9월)을 지정받았다. 국내 임상 1상을 마치고, 삼성서울병원과 아산병원에서 임상2상을 진행 중이며, 미국 임상1/2상을 종료했다. 한국 임상2상의 경우 미숙아 60명을 대상으로 50번째 환아가 등록되었으며, 내년 결과 발표가 예상된다.
세포치료제 SMUP-CELL은 차세대 줄기세포치료제 플랫폼으로 카티스템, PNEUMOSTEM 대비 대량 배양이 가능한 차세대 제조 플랫폼을 구축했다.
기존 기술은 줄기세포를 배양 후, 일일히 선별, 계대배양 후 보관, 냉동하는 작업이 필요했다. 배양을 사람이 직접하다 보니 수율 차이가 컸으나, 48시간 유효기간이 있어 글로벌 사업을 진행하기 쉽지 않았다.
따라서 자동화 과정을 위해 제대혈에서 작은 크기의 고효능 줄기세포를 까다롭게 선별, 52리터 바이오리액터에서 대량배양하도록 자동화 과정을 적용한 2세대 줄기세포치료제이다.
해당 기술을 이용한 파이프라인인 골관절염 치료제 SMUP-IA-01는 K&L grade 2~3 환자 12명을 대상으로 저용량 3명, 중용량 3명, 고용량 6명을 대상으로 임상1상을 진행했다. 관절강 내 1회 투약 후 6개월 관찰 임상으로, 국내 임상1상 결과에서 사망을 포함한 중대한 이상반응은 없었고, 약물사용제한 독성이 없는 것으로 결과가 나왔다.
이후 2021년 10월 임상2상을 승인받아 지난 3월 첫환자 투약에 들어갔다. K&L grade 2~3 환자 90명 대상(저용량 30명, 중용량 30명, 활성대조군 30명 예정)이며, 관절강내 1회 투약 후 1년 관찰 예정 및 장기추적 관찰 예정이다.
SMUP-IA-01 파이프라인은 기존의 히알루론산, 스테로이드 주사제로 대체되던 통증을 줄이는 관절강 주사제를 대체하며, 카티스템은 미세천공술, 연골 이식술 등 수술요법을 대체해 K&L grade 2~3 환자를 모두 커버하는 전략을 가져갈 예정이다.